研究人员揭示乙酰化如何调节着丝粒动力学染色体分离和有丝分裂进程
细胞分裂产生新细胞,为生命繁衍和发展奠定基础。有丝分裂是细胞周期中最短、最活跃的阶段。在有丝分裂过程中,染色体均匀分布在两个子细胞之间,保持基因组的完整性。
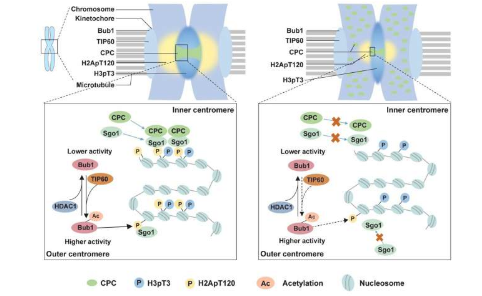
着丝粒是染色体的一个特殊区域,是各种蛋白质的募集平台,这些蛋白质对于维持姐妹染色单体的凝聚力和动粒的组装至关重要。这些动粒负责纺锤体微管的附着,从而使染色体在细胞分裂过程中聚集和正确分离。
着丝粒的结构或功能缺陷可能导致染色体错误分离,进而导致基因组不稳定。
Bub1(不受苯并咪唑1抑制的出芽蛋白)是一种丝氨酸/苏氨酸激酶,在有丝分裂期间发挥多种功能。它在前中期被募集到未附着的着丝粒,并促进其他下游蛋白质向着丝粒和着丝粒的募集。
蛋白质乙酰化是一种保守的翻译后修饰,存在于原核生物和真核生物中。1964年,研究人员首次发现组蛋白的乙酰化。后续研究发现,不仅组蛋白,许多非组蛋白也发生乙酰化修饰,参与调控多种细胞生命活动。
昆明理工大学和北京大学的张传茂教授及其同事发现了一种调控染色体聚集和分离的分子机制。研究人员在发表于《中国科学生命科学》上的论文中表明,在有丝分裂早期,TIP60乙酰化着丝粒上K424和K431位点的Bub1,从而增强了Bub1的激酶活性。
“当我们富集有丝分裂乙酰化蛋白时,我们在其中检测到了Bub1,”论文第一作者MengjieSun说道。“此外,我们观察到Bub1的乙酰化水平在有丝分裂早期显著上升。这表明Bub1乙酰化可能在该过程中发挥作用。”
这是他们研究的开始。随后,通过一系列实验,包括活细胞成像和生化技术,他们发现Bub1乙酰化对于染色体的正确排列和分离至关重要。Bub1乙酰化受损会导致染色体排列明显延迟和染色体分离缺陷,包括染色体滞后和后期桥形成。
接下来,他们通过体内和体外实验,确定乙酰转移酶TIP60负责Bub1乙酰化。
此外,研究人员还深入研究了TIP60介导的Bub1乙酰化如何调控染色体的聚集和分离,检测了其对下游蛋白向着丝粒募集的影响,发现当Bub1乙酰化被破坏时,CPC成分和Sgo1无法被有效募集到着丝粒。
先前的研究报告称,Bub1在T120(H2ApT120)处磷酸化H2A,以募集CPC和Sgo1。研究人员随后试图确定Bub1乙酰化如何影响H2ApT120的水平。正如他们所预料的那样,Bub1乙酰化增强了其激酶活性,从而促进了H2A的磷酸化。
“这就是Bub1乙酰化调节染色体聚集和分离的机制。”张教授总结道。
鉴于Bub1的乙酰化是整个细胞周期中动态的过程,他们还旨在确定负责脱乙酰化Bub1的酶。他们确定了一种必需的脱乙酰化酶HDAC1,它在细胞退出有丝分裂时介导Bub1的脱乙酰化。HDAC1对Bub1的过早脱乙酰化会损害Bub1的激酶活性,并导致着丝粒异常分解和染色体错误分离。
“这形成了细胞周期中Bub1的乙酰化和去乙酰化循环,”杨碧英博士解释说。
免责声明:本答案或内容为用户上传,不代表本网观点。其原创性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容、文字的真实性、完整性、及时性本站不作任何保证或承诺,请读者仅作参考,并请自行核实相关内容。 如遇侵权请及时联系本站删除。
