用于骨骼肌的新型和改良的药物输送分子
日本东京——东京都立大学的研究人员发明了一种新型药物输送分子,这是一种两性离子聚合物复合物,当注射到骨骼肌中时,可以帮助质粒 DNA 进入细胞,这是治疗性 RNA 和蛋白质表达的关键步骤。这种新化合物可以有效地与质粒 DNA 结合,而不会影响其结构。注射到小鼠肌肉中后,研究小组观察到了广泛的基因表达,有望应用于治疗严重的肌肉疾病。
药物输送系统是当今许多临床突破的基础。例如,COVID-19 疫苗使用脂质纳米颗粒包裹信使 RNA (mRNA),并通过称为内吞作用的过程将其带入细胞;进入细胞后,mRNA 通过“内体逃逸”释放,然后由细胞机制“翻译”成引发免疫反应的抗原。但是,虽然这些方法已经成功使用,但仍有挑战需要克服,例如载体的不必要聚集。随着治疗方法的多样化,研究人员正在寻找新的输送方法,以用于更广泛的应用。
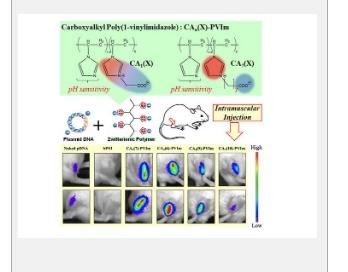
东京都立大学教授 Shoichiro Asayama 领导的研究小组一直在研究使用聚离子(一种带电荷的聚合物)将质粒 DNA (pDNA) 带入细胞。质粒 DNA 可以转录为信使 RNA 或翻译成蛋白质,使其成为一种多功能的治疗载体。它们也恰好是带负电荷的聚合物,可以与带正电荷的聚离子结合。然而,简单地制造一个大的带正电荷的聚合物远非理想,因为它们的电荷可能会对细胞产生毒性。最近的研究转向了两性离子,即一边带正电荷,另一边带负电荷的化合物。
现在,该团队设计出了第一种两性离子聚合物化合物 (CA-PVIm),其中含有咪唑阳离子(带正电荷),可以与 pDNA 复合。咪唑基团的优势在于正电荷分散在原子环上,这使其很有可能与 pDNA 紧密结合。带负电荷的部分由短碳氢链隔开的羧基组成;这些以不同的比例添加到聚合物链中。
在初步实验中,他们发现他们的新化合物在溶液中有一层结合水分子,这可能使它们具有生物惰性。与 pDNA 混合后,使用一种按长度分离 DNA 化合物的方法,表明 pDNA 可以成功与 CA-PVIm 复合。其他测量也表明,pDNA 的复杂层次结构得以保留。
研究团队将他们的化合物注射到小鼠的肌肉组织中,对其进行了测试。与裸露的 pDNA 相比,他们发现 pDNA 引起的基因表达范围要大得多。这清楚地表明,他们的多聚离子被吸收到细胞中,并经历了内体逃逸。他们还确定了一种最佳化合物,其中 7% 的可用位点带负电荷 (CA(7)-PVIm),效果最佳。由于它可以将货物运送到大块肌肉上,该团队的发现有望为严重的肌肉疾病带来新的治疗方法。
这项工作得到了日本学术振兴会科学研究补助金 (B)(JSPS KAKENHI 补助金编号 21H03820)的支持。
免责声明:本答案或内容为用户上传,不代表本网观点。其原创性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容、文字的真实性、完整性、及时性本站不作任何保证或承诺,请读者仅作参考,并请自行核实相关内容。 如遇侵权请及时联系本站删除。
